Nguyễn Thị Hải Lý1, Phan Mộng Thu2, Phan Thị Tú Anh2
[1] Khoa Tài nguyên & Môi trường – Trường Đại học Đồng Tháp
2 Khoa Nông nghiệp – Thủy sản & Phát triển nông thôn – Trường Cao đẳng Sóc Trăng
TÓM TẮT
Bùn lắng từ hệ thống xử lý nước thải ở các nhà máy chế biến thủy sản được thu gom và xử lý bằng phương pháp ủ compost hiếu khí đã được nghiên cứu. Thí nghiệm có ba nghiệm thức là C/N=25/1, C/N=30/1 và C/N=35/1 với ba lần lặp lại. Quá trình ủ hiếu khí để khối ủ thành thục khoảng 28 ngày, nhiệt độ của các khối ủ từ 29 – 44,1oC, lượng nitơ hữu cơ là 2,83 – 3,5 %N và lượng lân tổng số là 1,68 – 2,1 %P2O5. Thời gian ủ hiếu khí ngắn và phân hữu cơ sau ủ có thể được dùng cho sản xuất nông nghiệp. Nghiệm thức C/N=30/1 là thích hợp để ứng dụng vào xử lý bùn thải hữu cơ.
Từ khóa: Bùn lắng, phân compost, ủ compost hiếu khí.
ASBTRACT
The settled sludge from waste water treatment system in seafood processing factories were collected and treated by aerobic composting method. The experiment had three treatments ( C/N=25/1, C/N=30/1 and C/N=35/1) and three replications. Aerobic process were degraded completely about 28 days and temperature of waste were from 29 to 44.10; organic nitrogen were 2.83 – 3.5% and total phosphor was 1.68 – 2.1 %P2O5. Aerobic composting method took short time and organic manure can use in agriculture. The C/N=30/1 was the most suitable treatment to treat organic waste.
Key words: sludge, aerobic compost, compost manure.
I. ĐẶT VẤN ĐỀ
Trong những năm qua, sản xuất nông nghiệp đã có nhiều đóng góp cho sự phát triển kinh tế xã hội của vùng Đồng bằng Sông Cửu Long (ĐBSCL). Việc thâm canh cây lúa trên diện tích rộng lớn đã tạo ra một lượng lớn rơm rạ, đây là nguồn nguyên liệu có hàm lượng dinh dưỡng cao. Tuy nhiên, một phần rơm rạ được tận dụng để trồng nấm, phần rơm rạ còn lại trên đồng người nông dân lại đốt gây lãng phí dinh dưỡng và ô nhiễm môi trường.
Bên cạnh đó, các khu công nghiệp tại ĐBSCL đã và đang tạo ra nhiều thách thức lớn đối với sự bền vững của môi trường sinh thái, đặc biệt là bùn lắng từ hệ thống xử lý nước thải hiện vẫn chưa được quan tâm đầu tư đúng mức.
Vì vậy cần có biện pháp xử lý bùn thải và rơm rạ hợp lý để tận dụng trong sản xuất nông nghiệp, đạt hiệu quả kinh tế và ít gây ô nhiễm môi trường là một yêu cầu cấp bách. Thực tế có nhiều biện pháp được dùng để xử lý các phế phẩm này, trong đó phương pháp ủ phân compost đang được quan tâm và nghiên cứu [6]. Với phương pháp này, chúng ta có thể xử lý chất thải, tận dụng lại hàm lượng dưỡng chất có trong nguyên liệu ủ cho nông nghiệp và góp phần giảm thiểu ô nhiễm môi trường cho cộng đồng. Vì thế mà nghiên cứu xử lý bùn hoạt tính bằng biện pháp ủ phân compost trong điều kiện hiếu khí cần đã thực hiện.
II. PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Thành phần vật liệu ủ phân
Bùn hoạt tính: bùn sau hệ thống xử lý nước thải có độ ẩm cao, mùi hôi và màu đen được lấy tại các nhà máy xử lý nước thải tại khu công nghiệp An Nghiệp, Tỉnh Sóc Trăng. Bùn được thu gom chuẩn bị trước khi ủ khoảng 15 ngày.
Rơm là loại rơm vừa ủ nấm xong, lấy ngẫu nhiên trên khu đất trồng nấm của người dân tại một số tỉnh Đồng Bằng Sông Cửu Long.
Tỉ lệ phối trộn
Hỗn hợp được phối trộn với những tỉ lệ vật liệu khác nhau cho vào thùng ủ đảm bảo tỉ lệ C/N các nghiệm thức của thí nghiệm ủ là 25/1, 30/1, 35/1. Thí nghiệm được bố trí hoàn toàn ngẫu nhiên trong điều kiện hiếu khí với 3 nghiệm thức, 3 lần lặp lại. Các thùng hiếu khí được bố trí lần lượt nhằm mục đích đo nhiệt độ, ẩm độ, pH, và đánh giá cẩm quan về màu, mùi.
2.2. Các chỉ tiêu theo dõi
Trong quá trình ủ, theo dõi các thùng ủ những thông số sau:
– Nhiệt độ và việc đánh giá cảm quan được quan sát mỗi ngày/lần vào khoảng 8 giờ sáng của các thùng trong suốt quá trình ủ và được đo ở giữa khối ủ;
– Các chỉ tiêu ẩm độ, pH được đo 1 lần/tuần của các thùng trong suốt quá trình ủ;
– Thu mẫu trước khi ủ và sau khi ủ để phân tích các chỉ tiêu: tỉ lệ C/N, đạm hữu cơ, lân hữu cơ, tổng coliform, trứng ký trùng, khối lượng của hỗn hợp ủ.
2.3. Phương pháp phân tích
pH: tỉ lệ trích 1:2,5, đo bằng máy pH kế hiệu Aquatic 410.
Chất hữu cơ (%C): được xác định bằng phương pháp Walkley-black (Nelson & Sommer, 1996) [3].
Nitơ hữu cơ: xác định bằng phương pháp chưng cất Kjeldahl (Bremner, 1996) [3].
Tổng Phospho: vô cơ hóa mẫu đất bằng H2SO4 và HClO4, lọc hỗn hợp đã được vô cơ hóa, cho phản ứng với hỗn hợp thuốc thử Amonium molipdate, acid arcobic và antimoantartrate, sau đó đo mẫu ở bước sóng 882 nm [3].
Tổng Coliform: được đếm bằng phương pháp Most Probable Number (MPN) [3].
Trứng giun sán: phương pháp phù nổi dùng để định tính trứng giun đũa. Sử dụng phương pháp, dung dịch phù nổi Fullebom (1927). Nguyên lý của phương pháp này là dùng dung dịch có tỷ trọng lớn hơn tỷ trọng của trứng giun sán, đẩy trứng giun sán lên bề mặt của dung dịch đó [4].
2.4. Phương pháp xử lý số liệu
Các số liệu được xử lý bằng phần mềm Microsoft Excel 2003 và SPSS 16.0.
III. KẾT QUẢ THẢO LUẬN
3.1 Diễn biến của các thông số nhiệt độ, pH và ẩm độ trong quá trình ủ hiếu khí
3.1.1. Nhiệt độ
Kết quả nghiên cứu cho thấy, nhiệt độ giữa các nghiệm thức biến động trong khoảng 29,5 – 44,10C. Nhiệt độ giữa 3 nghiệm thức không có sự khác biệt đáng kể. Nhiệt độ đạt cực đại vào ngày thứ 5 ở nghiệm thức C/N = 25/1 (42,50C), vào ngày thứ 6 nghiệm thức C/N = 30/1 (44,10C), và nghiệm thức C/N = 30/1 (43,10C). Nhìn chung, có sự biến động lớn giữa nhiệt độ bên trong của các mẻ ủ với nhiệt độ môi trường. Nhiệt độ của các nghiệm thức tăng nhanh ở tuần đầu tiên sau đó giảm dần ở tuần tiếp theo, đến ngày thứ 21 tiến gần về nhiệt độ môi trường. Đây là một trong những dấu hiệu cho thấy rằng khối ủ đã đến giai đoạn thuần thục.
Điều này có thể giải thích như sau, do lúc đầu lượng vi sinh vật lớn, hoạt động mạnh và hàm lượng dưỡng chất trong các mẻ ủ cũng dồi dào, đặc biệt là oxy lại làm cho các vi sinh vật hoạt động mạnh hơn, tăng nhiệt độ mẻ ủ, nhất là trong tuần đầu tiên [7]. Các tuần sau đó, vi sinh vật bị chết vì thiếu oxy và chất dưỡng chất, nên nhiệt độ mẻ ủ hạ xuống thấp bằng nhiệt độ môi trường, đây cũng là lúc mẻ ủ đã hoai [8].
Nhiệt độ là chỉ số chỉ thị cho hoạt động phân hủy chất hữu cơ của vi sinh vật. Sự sinh nhiệt trong khối ủ liên quan đến hoạt động phân hủy chất hữu cơ của vi sinh vật [11]. Kết quả nghiên cứu cho thấy trong khoảng 9 ngày đầu tiên nhiệt độ khối ủ tăng cao chứng tỏ hoạt động phân hủy các hợp chất hữu cơ đang tăng mạnh. Sang ngày thứ 10 đến ngày thứ 20 nhiệt độ hạ thấp dần. Từ ngày 21 trở lên, nhiệt độ hạ xuống tương đương với nhiệt độ không khí, điều này chứng tỏ hoạt động phân hủy chất hữu cơ đã giảm mạnh, các hợp chất hữu cơ dễ phân hủy không còn và hỗn hợp ủ trở nên hoai mục.
Sự thay đổi nhiệt độ này giống với kết quả về ủ phân compost trong các khối ủ có kích thước nhỏ, nhiệt độ biến động trong khoảng 27 – 450C [9]. Tuy nhiên, nhiệt độ này thấp hơn nghiên cứu của Dương Minh Viễn [2] khi ủ phân hữu cơ có nguồn gốc từ bã bùn mía cho thấy nhiệt độ khối ủ đạt được trong khoảng 50 – 600C. Sở dĩ nhiệt độ không đạt đến mức tối ưu ở 55 – 600C là do lượng nguyên liệu cho vào mô hình ủ ít và do đó có sự khuếch tán nhiệt ra môi trường bên ngoài lớn, để đạt được nhiệt độ 55 – 600C lượng rác cho vào ủ tối thiểu là 1m3 [17]. Một tác giả khác cho rằng, trong quá trình ủ nhiệt độ cần duy trì là 55 – 650C, vì ở nhiệt độ này quá trình chế biến phân sẽ hiệu quả và tiêu diệt được mầm bệnh [5].
3.1.2. pH
Nghiên cứu chỉ ra rằng giá trị pH giữa các nghiệm thức dao động trong khoảng từ 7,67 ± 0,03 đến 8,23 ± 0,07 sau 28 ngày ủ (Bảng 1). Các nghiệm thức đều có pH tăng mạnh trong 7 ngày đầu, vào ngày thứ 7 đạt giá trị cao nhất (NT C/N=25/1 đạt 8,23 ± 0,07; NT C/N=30/1 đạt 8,13 ± 0,03; NT C/N=35/1 đạt 8,17±0,03) và các giá trị này khác biệt ý nghĩa thống kê (p<0,05). Giá trị pH vẫn duy trì khoảng 8,00 (NT C/N=25/1) và 8,03 (NT C/N=30/1 và C/N=35/1) cho đến ngày thứ 21. Giá trị pH tăng trong khối ủ (từ ngày 1 đến ngày 21) là do các vi sinh vật phân hủy các chất hữu cơ chứa nito tạo thành NH4+. Trong quá trình ủ phân nhiệt độ đống phân tăng nhanh do hoạt động phân hủy chất hữu cơ bởi vi sinh vật diễn ra mạnh, chuyển hoá các chất hữu cơ thành các sản phẩm phân hủy là amoniac và các chất hữu cơ khác, vì thế pH sẽ tăng trong phương pháp ủ hiếu khí [15]. NH4+ càng nhiều thì tạo ra môi trường kiềm, vì thế làm cho giá trị pH càng tăng [16].Từ ngày 21 đến ngày 28, giá trị pH giảm nhẹ và sau đó gần như ổn định. Nguyên nhân là do ở những ngày này quá trình chuyển hóa NH4+ thành NO3- xảy ra, đồng thời giải phóng ion H+, làm cho môi trường trở nên trung tính hơn.
Bảng 1. Giá trị pH giữa các nghiệm thức ủ hiếu khí theo thời gian
| Nghiệm thức | pH (Mean ± Std.E) | ||||
| Ngày 1 | Ngày 7 | Ngày 14 | Ngày 21 | Ngày 28 | |
| C/N = 25 | 7,73 ± 0,03d | 8,23 ± 0,07a | 8,10 ± 0,01ab | 8,00 ± 0,01bc | 7,87 ± 0,09cd |
| C/N = 30 | 7,67 ± 0,12c | 8,13 ± 0,03a | 8,00 ±0,06ab | 8,03 ± 0,09ab | 7,87 ±0,03bc |
| C/N = 35 | 7,80 ± 0,06c | 8,17±0,03a | 8,03±0,03ab | 8,03±0,07ab | 8,00±0,01b |
Ghi chú: trong cùng một hàng các chữ cái (a,b,c,d) giống nhau thì không có sự khác biệt về mặt thống kê qua phép thử Ducan.
Sau giai đoạn 28 ngày, tác giả nhận thấy rằng sản phẩm ủ ở tất cả các nghiệm thức đều có pH thay đổi từ 7,87 ± 0,09 đến 8,00±0,01 và đạt TCN 10 526 – 2002 của Bộ NN và PTNT (pH = 6-8) [1].
3.1.3. Ẩm độ
Ẩm độ ảnh hưởng khá quan trọng đến sự thành công của việc ủ phân. Sự thiếu hụt về ẩm độ sẽ gây cản trở vi sinh vật hoạt động vì chúng cần nhiều nước cho quá trình tổng hợp tế bào chất, do đó phải đảm bảo ẩm độ thích hợp trong quá trình ủ.
Giá trị độ ẩm của nghiệm thức C/N=25/1, C/N=30/1 và C/N=25/1 giảm dần theo thời gian và các giá trị này có sự khác biệt về mặt thống kê (p<0,05), trừ NT C/N=25/1 ẩm độ ở ngày 1 và ngày 7 không khác biệt thống kê (p>0,05). Khối ủ có giá trị ẩm độ cao nhất vào ngày đầu tiên, NT C/N=25/1 đạt 61,90 ± 0,87%, NT C/N=30/1 đạt 61,87±0,86% và NT C/N=35/1 đạt 62,17±0.35%, sau đó giảm dần cho đến ngày thứ 28. Khi kết thúc thí nghiệm, độ ẩm khối ủ của NT C/N=25/1 đạt 45,30±0,25%, NT C/N=30/1 đạt 43,07±0,18%, NT C/N=35/1 đạt 42,03±0,87% (bảng 2).
Bảng 2. Diễn biến ẩm độ (%) của các nghiệm thức ủ hiếu khí theo thời gian
| Nghiệm thức | Ẩm độ (%) (Mean ± Std.E) | ||||
| Ngày 1 | Ngày 7 | Ngày 14 | Ngày 21 | Ngày 28 | |
| C/N = 25 | 61,90 ± 0,87a | 59,17±0,33a | 53,97±1,47b | 50,30±0,87c | 45,30±0,25d |
| C/N = 30 | 61,87±0,86a | 59,27±0,19b | 57,77±0,34c | 50,73±0,40d | 43,07±0,18e |
| C/N = 35 | 62,17±0.35a | 60,13±0,45b | 55,17±0,49c | 48,73±0,58d | 42,03±0,87e |
Ghi chú: trong cùng một hàng các chữ cái (a,b,c,d) giống nhau thì không có sự khác biệt về mặt thống kê qua phép thử Ducan.
Kết quả thí nghiệm thấy rằng, trong 7 ngày đầu, ẩm độ của các khối ủ giảm dần từ 62,17±0.35% đến 59,17±0,33% do nhiệt độ của khối ủ cũng tăng cao. Điều này chứng tỏ khoảng ẩm độ này thích hợp cho hoạt động sống và chuyển hóa vật chất hữu cơ của vi sinh vật, ẩm độ tối ưu cho ủ phân hữu cơ trong khoảng 60 – 70% [12], [5].
Mặc dù từ ngày 14 đến ngày 28, chúng tôi tiến hành xới đảo 2 lần/tuần, nhưng ẩm độ của các nghiệm thức đến ngày thứ 28 nằm trong khoảng 42,03±0,87% – 45,30±0,25%. Kết quả này chưa đạt chuẩn của chất lượng phân ủ đầu ra, ẩm độ trong phân hữu cơ khoảng 30 – 40% [7] và TCN10 526-2002 là 35% [1].
Từ kết quả nghiên cứu, chúng tôi đề nghị rằng tần suất đảo trộn nên thực hiện thường xuyên hơn, đồng thời để giảm ẩm độ cần bổ sung lớp vật liệu hút ẩm ở nền đáy của các mô hình nhằm làm cho ẩm độ của phân đạt khoảng 35%.
3.2 Đánh giá tốc độ hoai mục và chất lượng phân hữu cơ của các nghiệm thức trong quá trình ủ
3.2.1. Khối lượng phân trước và sau ủ
Tốc độ hoai mục của phân hữu cơ liên quan đến sự thay đổi khối lượng của khối ủ. Quá trình khoáng hóa vật chất hữu cơ diễn ra càng mạnh làm cho khối lượng phân càng giảm do CO2, NH3, CH4, H2O,… được tạo ra trong quá trình phân hủy. Do đó, so sánh khối lượng của các khối ủ trước và sau khi thí nghiệm cũng giúp đánh giá được tốc độ hoai mục của các nghiệm thức.
Kết quả bảng 4 cho thấy khối lượng phân trước ủ và sau ủ khác biệt có ý nghĩa thống kê 5% qua phép thử T-test. Phần trăm sụt giảm của nghiệm thức lần lượt là H25-1 (48%), H30/1 (30%), H35/1 (25%). Trong điều kiện ủ hiếu khí, nghiệm thức H25/1 có tỉ lệ sụt giảm khối lượng cao nhất chứng tỏ tốc độ khoáng hóa vật chất hữu cơ diễn ra nhanh.
Bảng 3. Khối lượng phân (kg trọng lượng khô) các nghiệm thức trước ủ và sau ủ
| Nghiệm thức | Khối lượng tươi (kg) (Mean ± Std.E) | |
| Trước ủ | Sau ủ | |
| H25/1 | 15,27 ± 0,25a | 8,00 ± 0,44b |
| H30/1 | 15,17 ± 0,76a | 10,67 ± 1,53b |
| H35/1 | 15,83 ± 0,29a | 11,83 ± 0,76b |
Ghi chú: trong cùng một hàng các chữ cái (a,b) giống nhau thì không khác biệt có ý nghĩa thống kê 5% qua phép thử T-test
Từ kết quả nghiên cứu cho thấy, ủ compost bằng kỹ thuật hiếu khí phối trộn ở tỉ lệ C/N=25/1 sẽ có tốc độ khoáng hóa cao hơn các nghiệm thức C/N=30/1 và C/N = 35/1.
3.2.2. Tỉ lệ C/N
Có rất nhiều nhân tố ảnh hưởng đến quá trình phân hủy do vi sinh vật: trong đó cacbon và nitơ là cần thiết nhất, tỉ lệ C/N là thông số dinh dưỡng quan trọng nhất. Photpho (P) là nguyên tố quan trọng kế tiếp; Lưu huỳnh (S), canxi (Ca) và các nguyên tố vi lượng khác cũng đóng vai trò quan trọng trong trao đổi chất của tế bào. Nguồn Cacbon hữu cơ (có trong nguyên liệu nạp liệu) cần thiết cho cung cấp năng lượng và tạo sinh khối cơ bản quá trình đồng hoá thành tế bào mới, phần còn lại chuyển hoá thành CO2. Nitơ là thành phần chủ yếu cấu thành protein, acid nucleic, acid amin, enzyme, co-enzyme cần thiết cho sự phát triển và hoạt động của tế bào [14].
Vì vậy, tỉ lệ C/N là một trong những chỉ tiêu quan trọng khác để đánh giá mức độ hoai mục của phân hữu cơ. Trong quá trình ủ, khi tỉ lệ C/N giảm xuống còn khoảng 15 – 17 thì hô hấp của vi sinh vật thấp và ổn định [2]. Kết quả bảng 4 cho thấy tỉ lệ C/N của các nghiệm thức trước ủ và sau ủ khác biệt có ý nghĩa thống kê 5% qua phép thử T-test. Trong đó nghiệm thức H25/1 và K25/1 có tỉ lệ C/N thấp nhất, sau đó đến các nghiệm thức H30/1 và K30/1, tỉ lệ C/N cao nhất ở các nghiệm thức H35/1 và K35/1.
Bảng 4. Tỉ lệ C/N của các nghiệm thức trước ủ và sau ủ
| Nghiệm thức | Tỉ lệ C/N | |
| Trước ủ | Sau ủ | |
| H25/1 | 24,53 ± 0,50a | 12,67 ± 0,76b |
| H30/1 | 29,87 ± 0,83a | 12,90 ± 0,53b |
| H35/1 | 33,82 ± 0,54a | 15,37 ± 1,85b |
Ghi chú: trong cùng một hàng các chữ cái (a,b) giống nhau thì không khác biệt có ý nghĩa thống kê 5% qua phép thử T-test
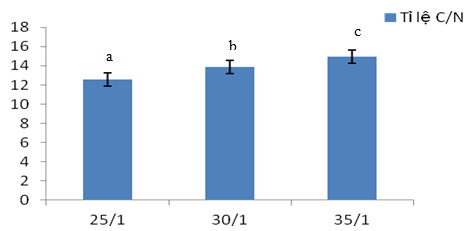
Kết quả phân tích tỉ số C/N của các hỗn hợp sau khi kết thúc thí nghiệm sẽ chỉ thị cho biết tốc độ phân hủy của từng khối ủ. Tỉ số C/N sau khi ủ càng thấp tương ứng với mức độ phân hủy các hợp hữu cơ càng nhanh.
Hình 2. Tỉ lệ C/N sau ủ hiếu khí 28 ngày
Ủ hiếu khí với thời gian 28 ngày, tỉ lệ C/N giữa các nghiệm thức biến động trong khoảng 12,67 ± 0,76 đến 15,37 ± 1,85. Nghiệm thức H30/1 và H25/1 thấp khác biệt có ý nghĩa thống kê so với nghiệm thức có tỉ lệ H35-1 qua phép thử Duncan (p<0,05). Như vậy, tốc độ phân hủy của 2 nghiệm thức H30/1 và H25/1 nhanh hơn so với nghiệm thức H35/1. Nguyên nhân là do ở khối ủ H35/1 được bổ sung lượng rơm vào nhiều hơn so với hai nghiệm thức hiếu khí còn lại. Trong rơm rạ chứa phần lớn là cellulose và ligin, đây là những hợp chất tương đối khó bị phân hủy sinh học, nếu muốn khoáng hóa hoàn toàn cần phải ủ một thời gian khá dài. Điều này cũng giải thích tại sao khối lượng sau khi ủ của nghiệm thức H35/1 là cao nhất so với hai nghiệm thức ủ hiếu khí còn lại. Trong khi đó nghiệm thức H30/1 cho kết quả tương đối ổn định, tỉ lệ C/N gần như bằng với tỉ lệ C/N ở nghiệm thức H25/1, chứng tỏ quá trình khoáng hóa diễn ra mạnh nhưng lượng mùn sau khi ủ lại cao hơn nghiệm thức H25/1. Nghiệm thức H25/1 có tỉ lệ C/N thấp là do lượng bùn thải của hê thống xử lý được bổ sung nhiều nên thích hợp quần thể vi sinh vật khoáng hóa hợp chất nitơ, chính điều này giải thích tại sao khối ủ của H25/1 có khối lượng thấp nhất. Từ kết quả nghiên cứu trên cho thấy nghiệm thức H30/1 thích hợp để thực hiện phối trộn trong quá trình ủ compost hiếu khí.
3.2.3 Đạm hữu cơ (%N)
Kết quả bảng 5 cho thấy phương pháp ủ hiếu khí hàm lượng đạm hữu cơ sau ủ tăng lên và các giá trị này khác biệt có ý nghĩa thống kê 5% so với lúc trước ủ.
Bảng 5. Hàm lượng đạm hữu cơ (%) của các nghiệm thức trước ủ và sau ủ
| Nghiệm thức | Trước ủ | Sau ủ |
| 25/1 | 1,51 ± 0,07b | 2,28 ± 0,07a |
| 30/1 | 1,53 ± 0,13b | 2,34 ± 0,08a |
| 35/1 | 1,42 ± 0,14b | 2,55 ± 0,08a |
Ghi chú: trong cùng một hàng các chữ cái (a,b) giống nhau thì không khác biệt có ý nghĩa thống kê 5% qua phép thử T-test.
Hàm lượng đạm tổng số giữa các nghiệm thức ủ hiếu khí biến động trong khoảng 2,28 – 2,55%. Ở phương pháp này vi sinh vật ưu khí hoạt động mạnh, liên tục sinh ra các khí NH3, CO2 và một vài khí khác. Lượng khí này thất thoát một phần ra ngoài trong khi xới trộn chính vì vậy làm cho lượng đạm mất đi. Phần NH3 còn lại được giải phóng sẽ kết hợp với các acid amin trong mùn tạo thành dạng nitơ dễ tiêu, đây chính là lượng nitơ cần thiết cho cây trồng sử dụng khi đem bón.
Trong phương pháp ủ hiếu khí hàm lượng đạm tổng số tăng cao ở nghiệm thức H30/1 (2,34%) và H35/1 (2,55%), thấp nhất ở nghiệm thức H25/1, qua xử lý thống kê nghiệm thức H30/1 khác biệt có ý nghĩa so với nghiệm thức H25/1 (p<0,05). Như vậy, ở các nghiệm thức có hàm lượng carbon trong khối phân hữu cơ cao thì hàm lượng đạm hữu cơ cũng cao, do vi sinh vật trong quá trình phân hủy cacbon hữu cơ tạo ra năng lượng cung cấp cho quá trình đồng hóa làm gia tăng sinh khối trong khối ủ, chính vì vậy làm cho hàm lượng tổng đạm trong phân sau ủ lại tăng. Ở phương pháp ủ này, hàm lượng đạm tổng cao ở nghiệm thức có tỉ lệ C/N = 30/1 và C/N = 35/1. Hàm lượng đạm tổng sau ủ đạt TCN10 526-2002 của Bộ NN và PTNT.
3.2.4. Tổng lân (% P2O5)
Hàm lượng tổng lân là một chỉ tiêu quan trọng để đánh giá chất lượng sản phẩm phân hữu cơ. Hàm lượng tổng lân giữa các nghiệm thức sau ủ tăng khác biệt có ý nghĩa 5% qua phép thử T-test so với lúc trước ủ và biến động trong khoảng 1,68 – 2,1 (%P2O5) (bảng 6). Trong quá trình phân giải, khối lượng phân giảm đi đáng kể so với khối lượng ban đầu nên hàm lượng tổng lân tăng lên [10], [8].
Bảng 6. Hàm lượng tổng lân (%P2O5) các nghiệm thức trước ủ và sau ủ
| Nghiệm thức | Trước ủ | Sau ủ |
| H25/1 | 1,58 ± 0,10a | 1,68 ± 0,07b |
| H30/1 | 1,85 ± 0,07a | 2,10 ± 0,04b |
| H35/1 | 1,44 ± 0,06a | 1,68 ± 0,13b |
Ghi chú: các hàng có cùng ký tự theo sau (a,b) thì không khác biệt có ý nghĩa thống kê 5% qua phép thử T-test
Nghiệm thức 30/1 có hàm lượng cao nhất, kế đến là nghiệm thức 25/1 và thấp nhất là nghiệm thức 35/1, các giá trị này khác biệt có ý nghĩa thống kê (p<0,05). Như vậy, trong phương pháp ủ hiếu khí hàm lượng lân tổng cao ở nghiệm thức có tỉ lệ C/N = 30/1. Tuy nhiên, kết quả này thấp hơn TCN10 526-2002 của Bộ NN & PTNT (theo TCN hàm lượng tổng lân không nhỏ hơn 2,5%) [1].
3.2.5. Mật số Coliform và trứng giun sán trước ủ và sau ủ
Kết quả phân tích cho thấy, các nghiệm thức khi bắt đầu ủ đều nhiễm Coliform và trứng giun sán, sau quá trình ủ mật độ của Coliform và trứng giun sán có sự suy giảm.
Trước khi ủ, Coliform dao động trong khoảng 12×103 đến 30×103(CFU/g), trứng giun sán dao động trong khoảng 428 – 587 trứng. Sau ủ Coliform dao động trong khoảng 4×103 đến 6×103(CFU/g), trứng giun sán dao động trong khoảng 270 – 290 trứng. Khả năng tiêu diệt trứng giun sán của các nghiệm thức còn thấp. Số lượng trứng giun sán giữa nghiệm thức trước ủ và sau ủ khác biệt có ý nghĩa thống kê 5% qua phép thử T-test.
Bảng 7. Mật số Coliform và trứng giun sán của các nghiệm thức trước ủ và sau ủ
| Nghiệm thức | Coliform (CFU/g) | Trứng giun sán (trứng/g) | ||
| Trước ủ | Sau ủ | Trước ủ | Sau ủ | |
| H25-1 | 30*103 ± 1,5.10a | 6*103 ± 1,115b | 587 ± 25a | 287 ± 31b |
| H30-1 | 15*103 ± 808a | 5*103 ± 252b | 476 ± 25a | 270 ± 17b |
| H35-1 | 12*103 ± 514a | 4*103 ± 15b | 428 ± 26a | 290 ± 10b |
Ghi chú: các hàng có cùng ký tự theo sau thì không khác biệt có ý nghĩa thống kê 5% qua phép thử T-test
Nhiệt độ cao sinh ra trong khối ủ là một trong những nguyên nhân tiêu diệt Coliform và trứng giun sán trong phân [13]. Tuy nhiên trong thí nghiệm này được thực hiện bằng phương pháp hiếu khí nên nhiệt độ không cao để tiêu diệt Coliform và trứng giun sán. Mật số Coliform và trứng giun sán vẫn còn khá cao sau khi kết thúc ủ.
Trứng giun đũa sống rất lâu trong phân, ở điều kiện tự nhiên chúng tồn tại 1 – 2 năm, Nhiệt độ thích hợp cho trứng phát triển là 250C, khi nhiệt độ lên đến 40 – 500C thì trứng chết trong 30 phút, nước nóng 600C trứng chết trong 5 phút, nhiệt độ nước nóng 700C trứng chết trong 1 -10 giây [13].
IV. KẾT LUẬN VÀ KIẾN NGHỊ.
4.1. Kết luận
Bùn thải sau hệ thống xử lý nước thải tại nhà máy chế biến thủy sản được xử lý bằng biện pháp ủ phân compost trong điều kiện hiếu khí, thời gian để các nghiệm thức thành thục khoảng 28 ngày cho các kết quả sau:
Nhiệt độ dao động khoảng 29,5 – 44,10C, giá trị ẩm độ thay đổi từ 42,03 ± 0,87 đến 45,30 ± 0,25, hàm lượng tổng lân cao ở nghiệm thức C/N = 30 (2,1%), mật số Coliform và trứng giun sán còn khá cao sau khi kết thúc ủ;
Giá trị pH ở các nghiệm thức đều dao động từ 7,87 đến 8,00, giá trị này của các nghiệm thức đều đạt TCN 10 526 – 2002;
Hàm lượng đạm tổng cao ở nghiệm thức có tỉ lệ C/N = 30/1 (2,34%) và C/N = 35/1 (2,55%). Hàm lượng đạm tổng sau ủ đạt TCN10 526-2002 của Bộ NN và PTNT.
Kết quả nghiên cứu cho thấy tỉ lệ C/N = 30/1 cho chất lượng phân tốt, có thể sử dụng làm phân bón cho cây trồng lâu năm và cây ngắn ngày.
4.2. Kiến nghị
Cần tiếp tục khảo sát hiệu quả của phân hữu cơ từ bùn thải tại nhà máy xử lý nước thải trong khu công nghiệp phối trộn với rơm sau thu hoạch lúa nhằm cải thiện đặc tính đất và năng suất trên một số rau màu và hoa kiểng;
Tiếp tục nghiên cứu ủ bùn thải thủy sản bằng phương pháp hiếu khí phối trộn với các vật liệu hữu cơ khác để mở rộng giải pháp xử lý bùn, tận dụng các phế thải hữu cơ khác đồng thời tạo được phân hữu cơ thích hợp cho nông nghiệp.
TÀI LIỆU THAM KHẢO
[1]. 10TCN 526-2002, Bộ Nông Nghiệp và Phát Triển Nông Thôn, QĐ số: 38/2002/QĐ-BNN.
[2]. Dương Minh Viễn, Võ Thị Gương, Nguyễn Mỹ Hoa, Phạm Văn Kim, Dương Minh, Cao Ngọc Điệp, Nguyễn Thị Kim Phương, Nguyễn Minh Đông, Trần Bá Linh, (2007). Sản xuất phân hữu cơ vi sinh từ bã bùn mía. Đề tài ươm tạo công nghệ, bộ môn Khoa học Đất và Quản lý Đất đai, khoa NN & SHƯD, Trường ĐHCT.
[3]. Đoàn Văn Cung, (1998), Sổ tay phân tích Đất, nước, phân bón, cây trồng, Viện thổ nhưỡng nông hóa. Nhà xuất bản nông nghiệp, p 91- 100 – 123 – 373.
[4] Nguyễn Thị Kim Lan, Nguyễn Thị Lê, Phạm Sỹ Lăng và Nguyễn Văn Quang, (2008). Giáo trình ký sinh trùng học thú y. Hà Nội: NXB Nông nghiệp.
[5]. Lê Hoàng Việt, 1998. Bài giảng quản lý – tái sử dụng chất thải hữu cơ. Khoa Công nghệ – Trường ĐHCT.
[6]. Lê Hoàng Việt, (2005). Giáo trình xử lý chất thải rắn. Khoa Môi Trường và Tài Nguyên Thiên Nhiên.
[7]. Lê Văn Căn, (1982). Phân chuồng. Viện khoa học kỹ thuật Nông Nghiệp Việt Nam. Nhà xuất bản Nông nghiệp.
[8]. Nguyễn Thị Thu Vân, (2001). Nghiên cứu dùng rơm ủ phân heo và chất thải từ xí nghiệp giết mổ tập trung tại thành phố Cần Thơ. Luận án Thạc sĩ, Trường ĐHCT.
[9]. Võ Thị Tường Vi, (2002). Đánh giá hiệu quả của biện pháp tang cường sinh học trong sản xuất compost từ rác thải sinh hoạt, Đồ án tốt nghiệp Trường ĐH Dân Lập Kỹ Thuật TPHCM.
[10]. Vũ Hữu Yêm, (1995). Giáo trình phân bón và cách bón phân, Nhà xuất bản Nông nghiệp Hà Nội.
[11]. Alexander, M., (1961). Microbial Ecology. Jonh Wiley and Sons. New York and London. p. 207 – 223.
[12]. Blain Metting, F.J., (1995). Soil microabibal ecology. In Composting as a Process Based on the Control of Ecological Selective Factors, Frederick C. Miller, LaTrobe University, Bundoora, Victoria, Australia, p. 515 – 537.
[13]. Burge W.D., Cramer W.N. and Epstein E, 1978. Destruction of pathogens in sewage sludge by composting. Trans ASEA 1978: 510-514.
[14]. Frank Schuchardt, (2005). Composting of Organic Waste, Environmental Biotechnology. Concepts and Applications.
[15]. Mark van Horn, (1995). Compost production and utilization – A grower’s guide, Fertilizer reseach and Education program, California Department of Food and Agriculture.
[16]. Rebollido, R., J. Martinez, Y. Aguilera, K. Melchor, I. Koerner, R. Stegmann, (2008): Microbial populations during Comppsting process of organic fraction of municipal solid waste.
[17]. Robert E. Graves and Gwendolyn M. Hattemer, (2000). Chapter 2 – compost Environmental Engineering National Engineering Handbook, 210-VI-NEH, February 2000.
………………………………………………………………………………….
Nguồn: Trích dẫn từ kỷ yếu Hội nghị môi trường toàn quốc lần thứ IV, Bộ tài nguyên và Môi trường, Hà Nội, 29/09/2015
…………………………………………………………………………………..

Leave a Reply