Ozon (O3) là một tác nhân oxi hoá mạnh với thế oxi hoá là 2,07V [44], ozon có thể xảy ra phản ứng oxi hoá với nhiều chất hữu cơ, các chất vô cơ trong nước, có thể làm sạch nước thải khỏi phenol, sản phẩm dầu mỏ, H2S, các hợp chất của asen, chất hoạt động bề mặt, xyanua, thuốc nhuộm, hidrocacbon thơm, thuốc sát trùng. Ozon có công thức phân tử là O3, ở nồng độ cao có màu xanh.
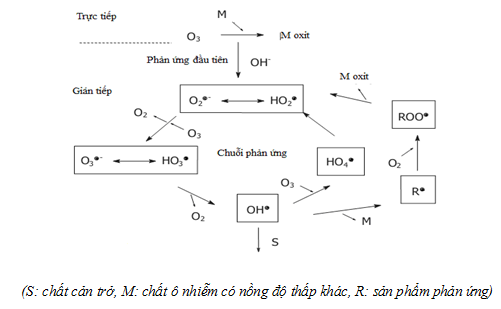
Ozon có thể oxi hóa các hợp chất hữu cơ trong nước theo hai con đường:
- Oxi hóa trực tiếp bằng phân tử ozon hòa tan trong nước.
- Oxi hóa gián tiếp qua gốc hydroxyl () khi phân hủy O3 trong nước.
Quá trình oxi hoá trực tiếp bằng phân tử O3 xảy ra tương đối chậm so với oxi hoá gián tiếp qua gốc hydroxyl () do sự phân huỷ ozon tạo ra [11, 41, 59, 98].
Hai con đường oxi hoá trực tiếp và gián tiếp của O3 với các chất hữu cơ cũng được Gottschalk và cộng sự (2010).
Trong môi trường axít, con đường oxi hoá trực tiếp bằng phân tử O3 là chủ yếu. O3 phản ứng với các hợp chất hữu cơ chứa liên kết đôi C=C hoặc các liên kết vòng thơm và phân hủy chúng thành axit cacboxylic và andehit [63, 102]. Phân tử O3 phản ứng dễ dàng với các chất hữu cơ như amin, phenol và các hợp chất vòng thơm nhưng phản ứng chậm với axit cacboxylic, andehit và rượu [53]. Trong môi trường kiềm, với sự có mặt của ion OH– , O3 bị phân hủy nhanh và hình thành gốc và gốc này oxi hóa các chất hữu cơ trong nước và nước thải[53]. Phản ứng của phân tử O3 (E0 = 2,07V) chậm và hạn chế trong khi gốc(E0 = 2,80V) phản ứng với hầu hết các chất hữu cơ trong nước và nước thải [34, 47, 104].
Phản ứng của ba phân tử O3 hình thành hai gốc:
Do đó, thay vì sử dụng Ozon, nhiều công trình nghiên cứu đã phát triển theo hướng tìm kiếm các tác nhân phối hợp với ozon hoặc chất xúc tác nhằm tạo ra gốc để nâng cao hiệu quả oxi hoá của ozon khi cần xử lý những hợp chất bền vững, khó phân huỷ trong nước và nước thải. Những tác nhân đưa thêm vào được nghiên cứu nhiều nhất là H2O2, chất xúc tác là các muối Ni(II), Co(II), oxit kim loại TiO2, MnO2…
Quá trình ozon hóa nước thải đồng thời diễn ra oxi hóa các tạp chất mang màu, khử trùng, hủy độc, làm bão hòa nước bằng oxy. Oxi hóa các hợp chất hữu cơ bằng ozon có thể tạo thành các sản phẩm trung gian: rượu, andehit, xeton, axít và do khả năng oxi hóa mạnh nên nó có thể oxi hóa sâu hơn để tạo ra CO2 và H2O.
Các yếu tố ảnh hưởng tới quá trình ozon hoá
Nồng độ ozon
– Quá trình ozon hoá trực tiếp bằng phân tử ozon:
Tốc độ phản ứng trực tiếp tỉ lệ với nồng độ ozon trong pha lỏng có nghĩa hiệu suất quá trình ozon hoá tăng. Tuy nhiên, nếu tiếp tục tăng nồng độ ozon đến khi các chất ô nhiễm đã bị ozon hoá hoàn toàn và không còn chất ô nhiễm trong nước nữa thì ozon sẽ tự phân huỷ trong nước.
– Quá trình ozon hoá gián tiếp bằng các gốc OH•
+ Dùng ozon kết hợp với tia UV (O3/UV):
Các phương trình trên cho thấy mối quan hệ giữa nồng độ ozon trong pha lỏng và nồng độ gốc . Trong khi đó, dựa trên các phản ứng giữa gốc với các chất ô nhiễm ta xác định được mối quan hệ giữa nồng độ với tốc độ phản ứng hay hiệu suất quá trình.
Ảnh hưởng của anion vô cơ
Cl– là một trong các chất phân hủy gốc làm giảm hiệu quả xử lý
Do phản ứng cạnh tranh giữa OH• với chất hữu cơ có hằng số tốc độ phản ứng cao hơn so với hằng số tốc độ phản ứng của với Cl– nên vẫn xử lý được chất hữu cơ trong nước thải nhưng hiệu quả giảm so với đã loại bỏ clo trước.
CO32- và HCO3– cũng có ảnh hưởng không nhỏ đến hiệu suất phản ứng. Nếu trong nước và nước thải chứa các anion bicacbonat và cacbonat ở môi trường pH cao, cân bằng cacbonat/bicacbonat sẽ nhanh chóng chuyển sang tạo cacbonat, đây là một chất phân hủy mạnh gốc .
Gốc OH• bị tiêu hao do độ kiềm cao trong nước thải theo phản ứng:
Khả năng phản ứng của CO32- với gốc mạnh hơn khả năng phản ứng của HCO3– và gốc .
Ảnh hưởng của pH
Hydro peroxyt phản ứng chậm với ozon, nhưng sản phẩm phân huỷ của hydro peroxyt là ion HO2– lại phản ứng rất mạng với ozon. Vì vậy, trong môi trường pH cao rất thuận lợi cho phản ứng giữa ozon và hydro peroxyt xảy ra làm tăng tốc độ quá trình phản huỷ ozon và tạo gốc . Nếu tăng pH lên một đơn vị, có thể tăng tốc độ hình thành gốc lên 10 lần.
Nhìn chung, ở điều kiện môi trường axít mạnh (pH <4), quá trình oxi hoá trực tiếp chiếm ưu thế, nhưng ở môi trường kiềm mạnh (pH ≥10), quá trình oxi hoá gián tiếp chiếm ưu thế. Ở môi trường trung tính (pH ≈ 7) cả hai quá trình oxi hoá trực tiếp và gián tiếp đều đóng vai trò quan trọng, phụ thuộc nhiều vào các chất ô nhiễm có mặt trong môi trường.

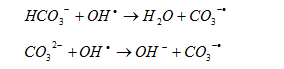
Leave a Reply